

美国看病-FDA给予Tecentriq另一类型晚期膀胱癌药物优先审评资格
2017-01-12来源:厚朴方舟
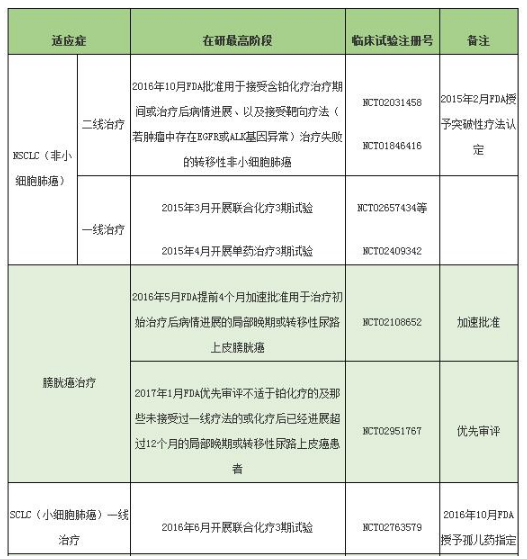
据海外医疗领导品牌厚朴方舟消息,罗氏子公司基因泰克宣布美国FDA已经接受了TECENTRIQ(atezolizumab)的sBLA(补充生物制品许可申请),并授予治疗不适于铂化疗的、及那些未接受过一线治疗方法的或化疗后已经进展超过12个月的局部晚期或转移性尿路上皮癌患者治疗的优先审评资格。尿路上皮癌占膀胱癌患者的90%,并会在肾盂、输尿管、尿道发病。
基因泰克CMO及产品全球开发领导人andra Horning博士称:在2016年5月,TECENTRIQ被FDA批准用于之前接受过治疗的晚期膀胱癌患者的治疗,成为该领域近30年来被批准的治疗药物。我们同FDA一道努力,争取将TECENTRIQ用于更多的晚期膀胱癌患者,尤其针对那些含铂化疗药物作为初始治疗不耐受的患者。
这次sBLA申请是基于临床2期试验IMvigor210的试验数据,FDA会在截止日2017年4月30日前做出审批结论。FDA的优先审评的认定主要是针对那些对严重疾病的治疗、预防或诊断能够带来重大改善、不受威胁性良好的药物。
TECENTRIQ目前所批准的适应症为接受铂化疗治疗过程中或治疗后出现疾病进展的及在术前或术后用含铂化疗治疗12个月内有疾病进展的局部晚期或转移性膀胱癌患者。这个适应证是在加速审评下根据肿瘤应答率和应答持续时间批准的。继续批准这个适应症则取决于在验证性试验临床获益的确证和描述。TECENTRIQ同时被批准用于接受含铂化疗治疗期间或治疗后病情进展、以及接受靶向治疗方法(若肿瘤中存在EGFR或ALK基因异常)治疗失败的转移性非小细胞肺癌(NSCLC)患者。
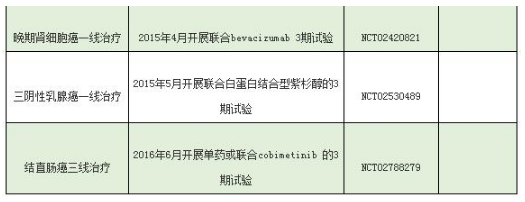
Atezolizumab主要实体肿瘤适应症临床信息(含已批准适应症)如下:
来源:医谷
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
上一篇:美国看病-约翰霍普金斯科学家跟踪代谢途径找到胰腺癌的药物组合 下一篇:美国看病-FDA受理Keytruda/化疗组合用于一线肺癌
相关推荐
厚朴方舟
厚朴方舟出国看病机构是中国企业初个拥有日本政府颁发的国际医疗从业资格证的公司,多年来整合了全球权威医疗资源,一直致力于打造“以患者为中心”的专业就医服务平台。公司在北京,上海,日本,美国均有分公司,为客户提供一站式海外就医服务。

咨询热线:400-086-8008
互联网药品信息服务资格证书编号:
(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号 京公网安备 11010502027115号