

出国看病:可缓解结直肠癌和阑尾癌,安进KRAS抑制剂前沿临床结果公布
2019-08-01来源:厚朴方舟
日前,安进(Amgen)公司在2019年第二季度财报的电话会议上公布了该公司的KRAS G12C抑制剂AMG 510的前沿研发进展。在此之前,安进公司于今年6月的ASCO年会上初次公布了KRAS G12C抑制剂AMG 510的1期临床试验结果。

前沿试验数据表明,AMG 510不但能够在非小细胞肺癌(NSCLC)患者中产生效果,也能为结直肠癌(CRC)患者和阑尾癌(appendiceal cancer)患者带来部分缓解。基于这些积极结果,该公司计划迅速推动AMG 510的开发,在今年启动支持监管申请的潜在注册性临床试验。
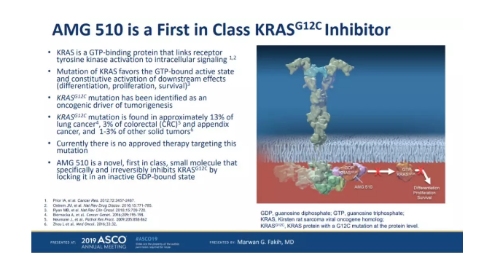
RAS基因家族是人类癌症中出现突变较为频繁的致癌基因之一,也是科研人员30多年来研发的重要靶点。KRAS基因中的突变在实体瘤中尤为常见,而KRAS G12C突变出现在13%的NSCLC患者,2%的CRC患者和1-2%的其它实体瘤患者中。然而KRAS蛋白由于缺乏与传统小分子药物结合的“口袋”,一直被认为是“不可成药”的靶点。
安进公司和其它生物技能公司通过对KRAS G12C突变体结构的研究,发现了这一突变体上与小分子药物结合的位点,也让靶向这一突变体成为可能。
▲AMG 510简介(图片来源:安进公司官网)
在今年6月的ASCO年会上,安进公司初次公布了KRAS G12C抑制剂AMG 510的1期临床试验结果。所有参与试验的患者都携带KRAS G12C突变,并且已经接受过标准治疗方法的治疗。在10名可评估的NSCLC患者中,缓解率达到50%,疾病控制率达到90%。然而,当时的数据显示AMG 510只能让结直肠癌患者疾病稳定,而未能显著缩小肿瘤的大小。
前沿的数据表明,接受AMG 510治疗的一名结直肠癌和一名阑尾癌患者达到RECIST 1.1标准下的临床缓解。这两名患者接受的AMG 510剂量为960 mg,是剂量递增试验中的较高药物剂量。安进公司研发执行副总裁David Reese博士表示,AMG 510在试验中表现出良好的不受威胁性和耐受性。今后的临床试验将使用960 mg的用药剂量,并可能探索960 mg以上的用药剂量。

▲AMG 510前沿研发信息(图片来源:安进公司官网)
在第二季度的电话会议上,安进公司的高管表示,临床前研究表明,AMG 510与免疫检查点抑制剂可能在抗癌方面产生协同效应,因此将开展AMG 510与PD-1抑制剂联用的临床试验。同时,该公司计划启动注册性2期临床试验。在今年9月初召开的IASLC第二十届世界肺癌大会(IASLC 2019 World Conference on Lung Cancer)上,该公司将公布AMG 510治疗肺癌的前沿临床结果。
我们期待安进公司为我们带来关于AMG 510的更多好消息。
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
上一篇:出国看病: 晚期食管癌抗PD-1单药治疗方法,默沙东Keytruda获美国FDA批准 下一篇:出国看病:罕见病新药UX007向FDA申请上市,治疗长链脂肪酸氧化代谢病(LC-FAOD)
相关推荐
厚朴方舟
厚朴方舟出国看病机构是中国企业初个拥有日本政府颁发的国际医疗从业资格证的公司,多年来整合了全球权威医疗资源,一直致力于打造“以患者为中心”的专业就医服务平台。公司在北京,上海,日本,美国均有分公司,为客户提供一站式海外就医服务。

咨询热线:400-086-8008
互联网药品信息服务资格证书编号:
(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号 京公网安备 11010502027115号