

美国治疗肺结核:高耐药性肺结核新药Pretomanid获FDA批准上市
2019-08-15来源:厚朴方舟
由于细菌耐药性的不断增加,多药耐药TB(multidrug-resistant TB)和广泛耐药TB(extensively drug-resistant TB)已经成为威胁人类健康的重大隐患。根据世界卫生组织的统计,在2016年,世界范围内有49万名新多药耐药TB患者,其中一小部分为广泛耐药TB患者。这些患者对多种治疗方法不耐受或者产生耐药性,因此这些患者的治疗选择非常有限。目前大多数广泛耐药TB患者可能需要接受多达8种抗生素的治疗,疗程长达18个月或更长。根据WHO的估计,对广泛耐药TB患者治疗的完成率大约为34%。
图源:创客贴
美国时间8月14日,美国权威部门(FDA)批准了用于治疗特定高度耐药肺结核(TB)的新药上市。这款新药由非盈利组织全球结核病药物开发联盟(TB Alliance)开发,名为pretomanid,将与贝达喹啉(bedaquiline)和利奈唑胺(linezolid)联用,治疗患有广泛耐药结核病的人群(XDR- TB)或多药耐药结核病(MDR-TB)患者。这是近40年来FDA批准上市的第三款抗肺结核新药,同时也是靠前款由非盈利组织开发和注册的肺结核新药。
这是依据抗菌和抗真菌药物的有限人群路径(LPAD pathway)下,批准的为期6个月的三联药物全口服方案的一部分LPAD途径由FDA建立,旨在鼓励进一步开发抗菌和抗真菌药物,以治疗严重的危及生命的感染,这些感染会影响有限的未满足需求的患者群体。
Pretomanid是一种新化学实体,是一类硝基咪唑嗪的化合物。结核病联盟于2002年获得该化合物的开发权。它已被开发为一种口服片剂,用于治疗结核病。并且该药物与贝达喹啉和利奈唑胺构成的组合治疗方法(BPaL)的效果,在名为Nix-TB的关键性临床试验中获得了证明。参加这一试验的109名患者包括广泛耐药性TB患者,和对已有治疗方法不耐受或无反应的多重耐药性患者。试验结果表明,在接受治疗6个月和治疗后6个月随访后,这一组合治疗方法的完成率达到89%,显著高于治疗广泛耐药TB患者的历史完成率。
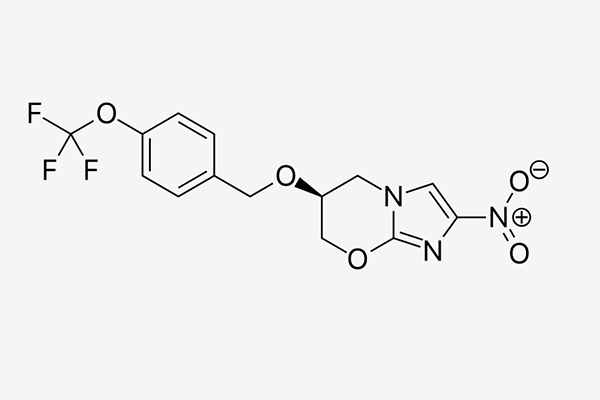
▲Pretomanid分子结构式(图片来源:Fvasconcellos 18:28, 3 June 2007 (UTC) [Public domain])
预计Pretomanid将于今年年底在美国上市。除美国FDA外,TB Alliance还提交了pretomanid作为BPaL方案的一部分,供欧洲药品管理局审查,并已向世界卫生组织提供数据,以考虑纳入高耐药结核病治疗指南。
肺结核小百科:
肺结核是由结核分枝杆菌引发的肺部感染性疾病,是一种严重威胁人类健康的疾病。人体感染结核菌后不一定发病,当抵抗力降低或细胞介导的变态反应增高时,才可能引起临床发病。若能及时诊断,并予合理治疗,大多可获临床痊愈。
图源:创客贴
肺结核有哪些典型症状?
肺结核起病缓慢,病程较长,通常表现为午后低热、乏力、食欲减退、消瘦、盗汗等。若肺部病灶进展播散,常呈不规则高热。妇女可有月经失调或闭经。
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
上一篇:海外医疗:治疗4种视网膜疾病,再生元Eylea单剂量预充式注射器获FDA批准 下一篇:治疗过度嗜睡,“first-in-class”发作性睡病新药获美FDA批准
相关推荐
厚朴方舟
厚朴方舟出国看病机构是中国企业初个拥有日本政府颁发的国际医疗从业资格证的公司,多年来整合了全球权威医疗资源,一直致力于打造“以患者为中心”的专业就医服务平台。公司在北京,上海,日本,美国均有分公司,为客户提供一站式海外就医服务。

咨询热线:400-086-8008
互联网药品信息服务资格证书编号:
(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号 京公网安备 11010502027115号