

日本看病-日本初次获批生物单抗药物Brodalumab
2016-07-07来源:厚朴方舟
据出国看病服务机构厚朴方舟消息,Brodalumab于2016年7月4日获得日本医药品医疗器械综合机构(PMDA)批准上市,并由日本协和发酵麒麟株式会社在日本地区销售,商品名为Lumicef®。
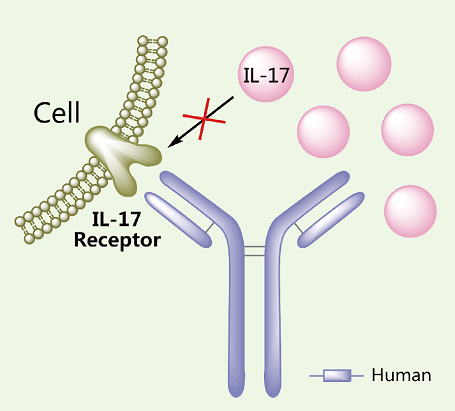
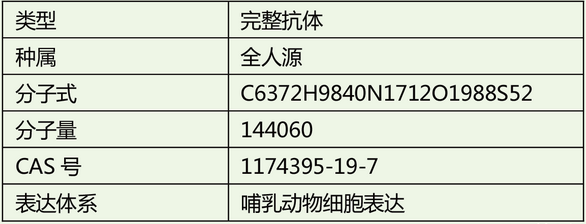
单抗药物Brodalumab结构
Brodalumab是一种白细胞介素17(IL-17)受体的抑制剂,能选择结合IL-17受体并阻止其与IL-17A、IL-17F及其它类型IL-17的结合,抑制银屑病相关炎症应答反应。该药批准的适应症为寻常型银屑病、银屑病性关节炎、脓泡型银屑病和红皮症型银屑病。Lumicef®是一种皮下注射液,每只1.5 mL注射器含210mg的brodalumab。介绍剂量为每周一次,每次210mg,初次于第0、1、2周给药,此后每2周一次。
2014年Brodalumab再次获得出色的临床III期斑块状银屑病数据,这款药物在一项一对一的研究中打败强生的重磅药物优特克单抗。吸引住众人的眼球。其次,2015年5月,临床数据显示Brodalumab与患者自杀倾向相关后,安进宣布终止与阿斯利康关于Brodalumab的合作。安进的这一决定,一度使这个曾被认为能“快速通过FDA审批和上市、并有望成为潜在重磅产品”的研发工作蒙上了一层厚厚的阴云。 ,在 关头阿斯利康也不要Brodalumab,他找好了退路,阿斯利康宣布与Valeant制药公司达成合作,将Brodalumab的开发及商业化 权利授权给Valeant。Valeant将拥有Brodalumab开发及商业化的全球 权利(除了日本及其他一些亚洲国家,这些地区由日本药企协和发酵麒麟持有),同时也将承担与Brodalumab监管审批相关的所有开发成本。
brodalumab在斑块状银屑病和银屑病性关节炎两个疾病治疗方面表现出不俗的效果,获批后也前景黯淡。因为IL-17A药物领域中的权威专家诺华公司已经于2015年1月份上市了同类药物Cosentyx。此外,礼来公司IL-17A药物ixekizumab也于2016年3月获批。
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
上一篇:日本看病-卫材新型抗癌药成为分化型甲状腺癌临床新标准 下一篇:日本看病-欧盟批准武田巩固治疗霍奇金淋巴瘤干细胞移植的抗癌药
相关推荐
厚朴方舟
厚朴方舟出国看病机构是中国企业初个拥有日本政府颁发的国际医疗从业资格证的公司,多年来整合了全球权威医疗资源,一直致力于打造“以患者为中心”的专业就医服务平台。公司在北京,上海,日本,美国均有分公司,为客户提供一站式海外就医服务。

咨询热线:400-086-8008
互联网药品信息服务资格证书编号:
(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号 京公网安备 11010502027115号