

2022整理丨胆管癌靶向免疫药物有哪些治疗效果如何
2022-04-28来源:厚朴方舟
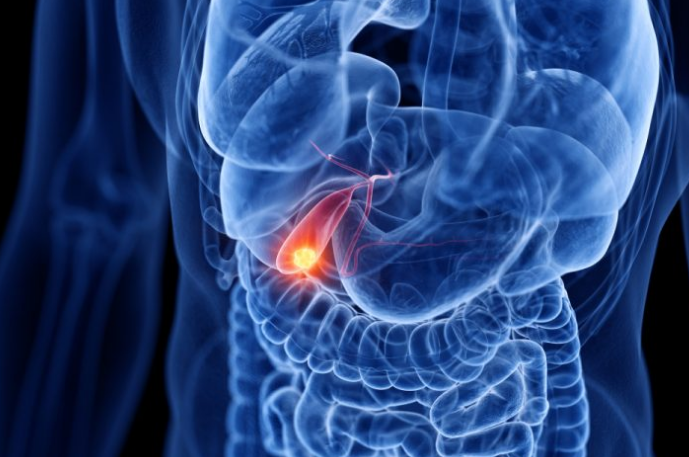
胆管癌是一种侵袭性较强且预后较差的恶性肿瘤,化疗作为晚期胆管癌的主要治疗手段,效果不佳,且常常出现耐药,因此晚期胆管癌患者急需更有效的治疗手段。近年来,研究人员一直在探索针对胆管癌靶向和免疫治疗,目前已有多款药物显现出突出的效果。那么这些靶向免疫药物治疗胆管癌效果如何?
▲图源:europeanpharmaceuticalreview
一、胆管癌的靶向治疗
1、头款胆管癌靶向药物Pemazyre
2020 年 4 月,成纤维细胞生长因子受体(FGFR)抑制剂Pemazyre(培米替尼)获美国 FDA 批准上市,成为全球头款胆管癌靶向药物。临床研究结果显示,Pemazyre将胆管癌的中位无进展生存期(PFS)和总生存期(OS)成倍延长。
今年3月,Pemazyre(培米替尼)也被日本厚生劳动省(MHLW)批准,可应用于胆管癌的治疗[1]。
▲图源:prtimes.jp
2、Futibatinib延长胆管癌生存期三倍以上
今年3月,美国FDA已经接受Futibatinib的新药申请(NDA),用于治疗携带FGFR2基因重排(包括基因融合)的局部晚期或转移性胆管癌经治患者[2]。

▲图源:参考来源[2]
2期FOENIX-CCA2研究结果显示,futibatinib治疗携带FGFR2基因重排(包括基因融合)、接受过至少一种方案治疗失败的局部晚期或转移性胆管癌的缓解率(ORR)为41.7%;中位缓解持续时间(DOR)为9.7个月,72%的患者缓解时间超过6个月,疾病控制率(DCR)为82.5%;中位无进展生存期(PFS)为9.0个月、中位总生存期(OS)为21.7个月,延长胆管癌生存期三倍以上(二线化疗的总生存期仅6个月)[3]。
3、Truseltiq提高胆管癌缓解率一倍以上
2021年6月,美国食品和药物管理局(FDA)已加速批准Truseltiq(infigratinib),用于治疗先前接受过治疗、携带FGFR2融合或重排的局部晚期或转移性胆管癌(CCA)患者。
▲图源:参考来源[4]
Infigratinib的获批主要是基于一项单臂的II期临床研究数据,结果显示,接受Truseltiq治疗的患者中,缓解率(ORR)为23%,与二线化疗缓解率仅10%相比,提高一倍以上;中位缓解持续时间(DoR)5.0个月[4]。
4、Entrectinib治疗胆管癌缓解率达54.5%
Entrectinib是一款针对ROS1、ALK及NTRK融合的泛靶点药物,血脑屏障的通透作用良好。2019年8月,美国FDA批准Entrectinib(Rozlytrek)上市,治疗携带NTRK基因融合的成年和青少年癌症患者(包括胆管癌患者);早在2019年6月,Entrectinib已在日本成功上市。

▲图源:参考来源[6]
在Entrectinib治疗实体瘤的临床试验中共纳入来自10类实体瘤的患者,其中就包括了胆管癌患者。结果显示,Entrectinib治疗这部分实体瘤患者的缓解率达到了54.5%,其中超过25%的患者实现了临床完全缓解;中位缓解持续时间(DoR)为10.4个月[6]。
二、胆管癌免疫治疗
相比进展颇丰的胆管癌靶向治疗,胆管癌的免疫治疗目前仅有一款药物的效果显著优于传统方案。
1、初款效果显著的胆管癌一线免疫治疗
2021年11月,针对胆管癌一线免疫治疗的TOPAZ-1 3期试验结果公布,此次数据表明,抗PD-L1药物Imfinzi(英飞凡,通用名:durvalumab,度伐利尤单抗)联合化疗显著延长了胆管癌患者的总生存期(OS)、无进展生存期(PFS),显著提高缓解率(ORR)[5]。

▲图源:参考来源[5]
虽然胆管癌的恶性程度较高,但靶向治疗、免疫治疗等创新方案的出现为胆管癌患者提供了新的选择,也为患者带来了新的希望。相信随着临床研究的深入开展,将会有越来越多的创新方案获批于临床,让更多胆管癌患者受益。
厚朴方舟作为国内海外医疗服务机构的佼佼者,与世界胆管癌权威专家均有着深入的合作关系,可以为胆管癌患者提供远程会诊及一站式出国看病,确定优选诊治方案。如有需要或希望了解更多胆管癌治疗内容,可以直接在线咨询医学顾问或拨打热线400-086-8008联系我们。
参考来源:
[1] インサイト・コーポレーション、ペマジール®(ペミガチニブ)の国内製造販売承認取得を発表
[2] U.S. Food and Drug Administration (FDA) Accepts for Priority Review Taiho Oncology's New Drug Application for Futibatinib for Cholangiocarcinoma
[3] Taiho Oncology Announces Presentation of Phase 2 Data for Futibatinib (TAS-120) in Advanced Intrahepatic Cholangiocarcinoma at Virtual AACR Annual Meeting 2021
[4] BridgeBio Pharma’s Affiliate QED Therapeutics and Partner Helsinn Group Announce FDA Approval of TRUSELTIQTM (infigratinib) for Patients with Cholangiocarcinoma.
[5] Imfinzi plus chemotherapy significantly improved overall survival in 1st-line advanced biliary tract cancer in TOPAZ-1 Phase III trial at interim analysis
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
上一篇:胆管癌靶向治疗新进展 胆管癌新靶向药Derazantinib疾病控制率达74% 下一篇:胆管癌首款免疫疗法获FDA批准 免疫治疗已成为胆管癌的一线选择
厚朴方舟
厚朴方舟出国看病机构是中国企业初个拥有日本政府颁发的国际医疗从业资格证的公司,多年来整合了全球权威医疗资源,一直致力于打造“以患者为中心”的专业就医服务平台。公司在北京,上海,日本,美国均有分公司,为客户提供一站式海外就医服务。
相关服务介绍

精密体检
日本医疗体检综合服务平台高性价比的专业体检套餐


远程会诊
足不出户与国际医学专家沟通新型用药方案和治疗方案


海外就医
专业的一站式海外就医服务国外专家预约、落地安排


咨询热线:400-086-8008
互联网药品信息服务资格证书编号:
(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号 京公网安备 11010502027115号