

2021年ASCO:胆管癌靶向药物效果公布,生存期显著延长
2021-06-09来源:厚朴方舟
胆管癌恶性程度较高,无法手术的患者标准治疗为化疗(吉西他滨联合顺铂),但一线治疗失败后,二线化疗的应答率不足10%,中位总生存期仅6个月左右,预后极差,急需新的治疗方案。随着靶向治疗的出现,胆管癌治疗的效果也出现了进一步的提升。2020年4月,头款胆管癌靶向药Pemazyre(pemigatinib,培米替尼)获批上市,显著改善了一线治疗失败后胆管癌患者的预后。
今年的美国临床肿瘤学会(ASCO)中,研究人员对Pemazyre治疗胆管癌的数据进行了更新。
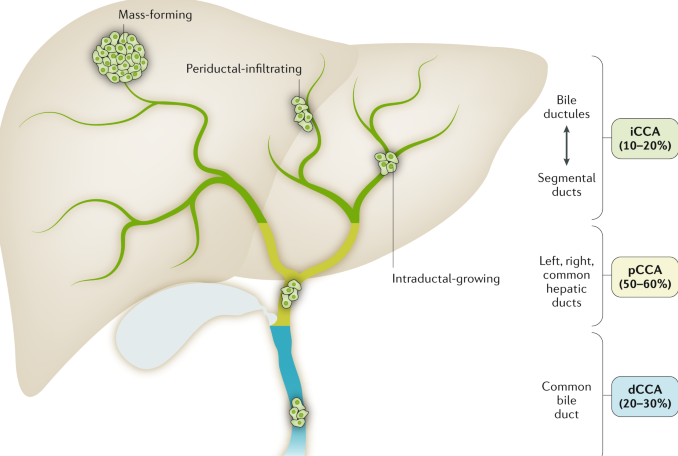
▲胆管癌三种类型:肝内胆管癌(iCCA)、肝门部胆管癌(pCCA)和远端胆管癌(dCCA),图源:springernature
头款胆管癌靶向药Pemazyre效果显著
2020年4月,Pemazyre率先获得美国FDA批准,用于治疗先前已接受过治疗、存在FGFR2融合或重排、不能手术切除的局部晚期或转移性胆管癌患者;2021年3月日本厚生劳动省(MHLW)批准Pemazyre用于治疗胆管癌。
两次批准均基于FIGHT-202研究的数据,该研究在先前已接受过治疗的局部晚期或转移性胆管癌患者中开展,评估了Pemazyre的效果和安全性。研究结果于2019年在欧洲肿瘤内科学会(ESMO)中公布,并发表在国际知名临床学术期刊《Lancet Oncol》(柳叶刀·肿瘤)上。

▲图源:sciencedirect
研究结果显示,Pemazyre二线治疗携带FGFR2基因融合的胆管癌患者的缓解率(ORR)可达35.5%,中位无进展生存期(mPFS)6.9个月。
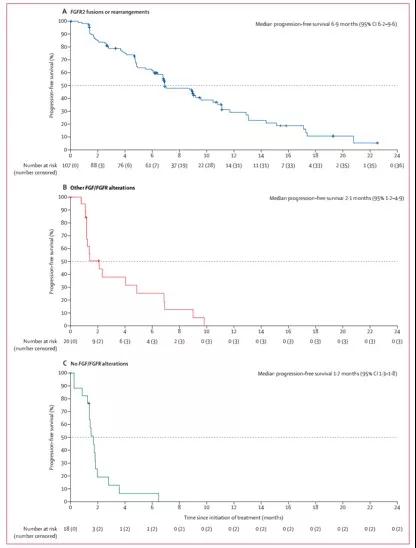
▲图源:[2]
另外,此项研究中还针对Pemazyre二线治疗携带FGFR2基因融合(A组)、携带其他FGF/FGFR基因突变(B组)、没有携带其他FGF/FGFR基因突变(C组)的效果进行了对比分析,结果显示,Pemazyre在A组表现优异,相比其他两个组,中位无进展生存期和总生存期均大幅度延长(PFS,A组:6.9个月,B组:2.1个月,C组:1.9个月;OS,A组:21.1个月,B组:6.7个月,C组:4.0个月)。
基于以上数据,美国FDA规定,使用Pemazyre治疗胆管癌之前,必须进行FGFR2基因的融合或重排突变检测。
2021年ASCO:Pemazyre效果令人惊喜
在2021年美国临床肿瘤学会(ASCO)中,培米替尼的临床试验FIGHT-202更新了总生存期数据。
存在FGFR2基因融合突变或重排突变的胆管癌患者,使用Pemazyre病灶缩小超过30%,中位无进展生存期(mPFS)为7个月,中位总生存期为17.5个月,确定的治疗应答率为37%。
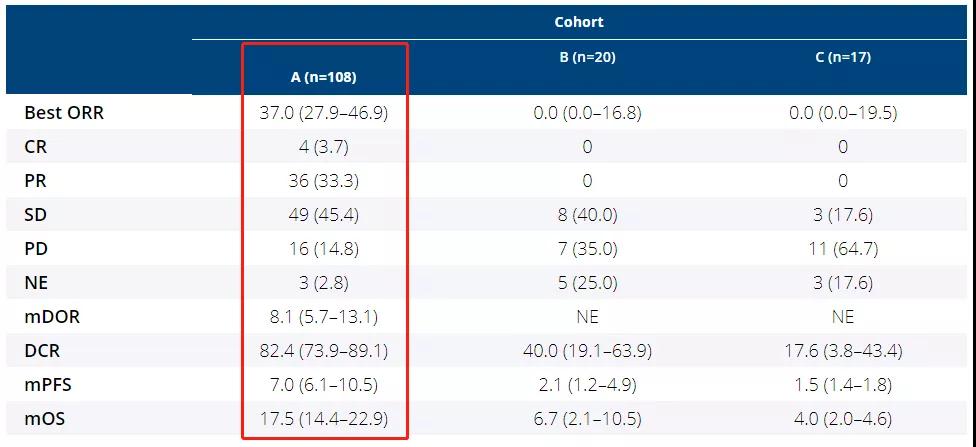
▲图源:meetinglibrary
这意味着,存在FGFR2基因融合突变的胆管癌患者,使用Pemazyre治疗,效果可佳,获益明显。对于一直缺乏靶向药物的晚期胆管癌患者,这无疑是个好消息。
近年来,针对胆管癌,临床涌现了更多的小分子靶向治疗的相关研究,且靶向药物在胆管癌治疗领域显现出良好的效果,除了Pemazyre,也涌现了其他的胆管癌治疗药物(了解更多可阅读:胆管癌靶向治疗时代来临,无进展、总生存期双延长)。相信在未来,胆管癌患者将继续受益于靶向药物,延长生存期。如希望了解更多有关胆管癌治疗方案,可拨打热线400-086-8008联系我们。
参考来源:
[1] FDA grants accelerated approval to pemigatinib for cholangiocarcinoma with an FGFR2 rearrangement or fusion
https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-accelerated-approval-pemigatinib-cholangiocarcinoma-fgfr2-rearrangement-or-fusion
[2] Pemigatinib for previously treated, locally advanced or metastatic cholangiocarcinoma: a multicentre, open-label, phase 2 study
https://www.sciencedirect.com/science/article/abs/pii/S1470204520301091?via%3Dihub=
[3] Pemigatinib for previously treated locally advanced/metastatic cholangiocarcinoma (CCA): Update of FIGHT-202.
https://meetinglibrary.asco.org/record/197197/abstract
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
上一篇:食管癌一线治疗和辅助治疗药物Opdivo接连获批,显著延长生存期 下一篇:阿尔茨海默病新药获批,时隔18年获批新治疗方法
相关推荐
厚朴方舟
厚朴方舟出国看病机构是中国企业初个拥有日本政府颁发的国际医疗从业资格证的公司,多年来整合了全球权威医疗资源,一直致力于打造“以患者为中心”的专业就医服务平台。公司在北京,上海,日本,美国均有分公司,为客户提供一站式海外就医服务。

咨询热线:400-086-8008
互联网药品信息服务资格证书编号:
(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号 京公网安备 11010502027115号