

乳腺癌靶向新药—TUKYSA获批用于治疗HER2阳性乳腺癌
2020-04-21来源:厚朴方舟
HER2阳性乳腺癌患者的肿瘤中含有一种高水平的蛋白质,称为人表皮生长因子受体2(HER2),可促进癌细胞的生长。据估计,到2020年,美国将诊断出279,100例新乳腺癌病例,其中 HER2阳性的乳腺癌病例占15%至20%。从历史数据上看,与HER2阴性乳腺癌相比,HER2阳性乳腺癌往往更具侵略性并且更容易复发。高达50%的转移性HER2阳性乳腺癌患者会随时间发展脑转移。
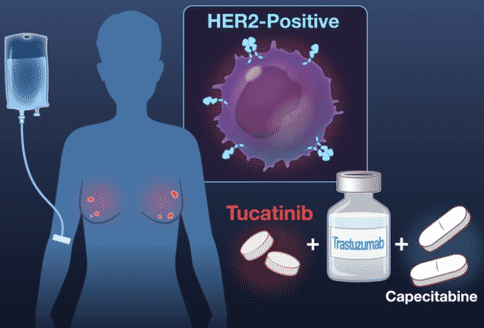
 日前,美国权威部门(FDA)批准HER2高选择性口服小分子激酶抑制剂TUKYSA(图卡替尼,tucatinib)片剂联合曲妥珠单抗和卡培他滨的三药治疗方案,用于晚期无法手术切除或转移性HER2阳性乳腺癌的成年患者,包括发生脑转移的患者,这些乳腺癌患者先前已接受过一种或多种抗HER2治疗方案。
日前,美国权威部门(FDA)批准HER2高选择性口服小分子激酶抑制剂TUKYSA(图卡替尼,tucatinib)片剂联合曲妥珠单抗和卡培他滨的三药治疗方案,用于晚期无法手术切除或转移性HER2阳性乳腺癌的成年患者,包括发生脑转移的患者,这些乳腺癌患者先前已接受过一种或多种抗HER2治疗方案。
此次批准是基于一项名为HER2CLIMB的随机(2:1),双盲,安慰剂对照试验。试验中纳入了612例先前曾接受过HER2阳性,不可切除的局部晚期或转移性乳腺癌的患者,评估对比了TUKYSA、曲妥珠单抗和卡培他滨的联合治疗方案,与曲妥珠单抗和卡培他滨用药方案的效果。相关数据于2019年12月发表在《新英格兰医学杂志》上。
该研究中有48%的患者存在脑转移或有脑转移史。试验的主要终点为无进展生存期(PFS),其他次要终点包括总生存期(OS),有脑转移病史或存在脑转移病的患者的PFS以及确定的客观缓解率(ORR)。
数据结果显示,与对照组(曲妥珠单抗+卡培他滨方案)相比,TUKYSA+曲妥珠单抗+卡培他滨方案表现出了更好的效果:癌症进展或死亡风险(PFS)显著降低了46%(中位PFS:7.8个月 vs 5.6个月),达到了试验主要终点。在中期分析时,该试验也达到了2个关键次要终点:与对照组相比,TUKYSA +曲妥珠单抗+卡培他滨三药方案的总生存期(OS)有所提高(中位OS:21.9个月 vs 17.4个月),死亡风险降低34%,客观缓解率提高近一倍(ORR:40.6% vs 22.8%)。对于基线时有脑转移的患者,与对照组相比,TUKYSA+曲妥珠单抗+卡培他滨方案也显示出优越的PFS数据(中位PFS:7.6个月 vs 5.4个月),将疾病进展或死亡风险显著降低了52%。
在接受TUKYSA治疗的患者中,有26%发生了严重的不良反应,有2%或更多发生的严重不良反应为腹泻(4%),呕吐(2.5%),恶心,腹痛和癫痫发作(各2%)。其中常见的不良反应是腹泻,掌跖红细胞感觉障碍,恶心,疲劳,肝毒性,呕吐,口腔炎,食欲下降,腹痛,头痛,贫血和皮疹,发生在20%或更多的患者中。接受TUKYSA治疗的患者中有6%发生不良反应,导致治疗中断。导致TUKYSA停药的不良反应(在1%或更多的患者中)是肝毒性(1.5%)和腹泻(1%)。
 图源:seattlegenetics
图源:seattlegenetics
关于TUKYSA(tucatinib)
Tukysa是一种靶向HER2的口服小分子酪氨酸激酶抑制剂(TKI)在体外(在实验室研究中),TUKYSA抑制HER2和HER3的磷酸化,从而抑制下游MAPK和AKT信号传导以及细胞生长(增殖),并在表达HER2的肿瘤细胞中显示出抗肿瘤活性。在体内(在活生物体中),TUKYSA抑制表达HER2的肿瘤的生长。与单独使用任何一种药物相比,TUKYSA和抗HER2抗体曲妥珠单抗的组合在体外和体内均显示出增强的抗肿瘤活性。
参考文献:
https://investor.seattlegenetics.com/press-releases/news-details/2020/Seattle-Genetics-Announces-US-FDA-Approval-of-TUKYSA-tucatinib-for-People-with-Advanced-Unresectable-or-Metastatic-HER2-Positive-Breast-Cancer/default.aspx
https://www.cancer.org/content/dam/cancer-org/research/cancer-facts-and-statistics/annual-cancer-facts-and-figures/2020/cancer-facts-and-figures-2020.pdf
https://www.nejm.org/doi/full/10.1056/NEJMoa1914609
厚朴方舟2012年进入海外医疗领域,总部位于北京,建立了由全球权威医学专家组成的美日名医集团,初个拥有日本政府官方颁发的海外医疗资格的企业。如果您有海外就医的需要,请拨打免费热线400-086-8008进行咨询!
本文由厚朴方舟编译,版权归厚朴方舟所有,转载或引用本网版权所有之内容须注明"转自厚朴方舟官网(www.hopenoah.com)"字样,对不遵守本声明或其他违法、恶意使用本网内容者,本网保留追究其法律责任的权利。
上一篇:没有了 下一篇:三阴性乳腺癌治疗:新型三阴性乳腺癌靶向药获美国FDA批准
厚朴方舟
厚朴方舟出国看病机构是中国企业初个拥有日本政府颁发的国际医疗从业资格证的公司,多年来整合了全球权威医疗资源,一直致力于打造“以患者为中心”的专业就医服务平台。公司在北京,上海,日本,美国均有分公司,为客户提供一站式海外就医服务。
相关服务介绍

精密体检
日本医疗体检综合服务平台高性价比的专业体检套餐


远程会诊
足不出户与国际医学专家沟通新型用药方案和治疗方案


海外就医
专业的一站式海外就医服务国外专家预约、落地安排


咨询热线:400-086-8008
互联网药品信息服务资格证书编号:
(京)·非经营性·2015·0179
厚朴方舟健康管理(北京)有限公司 版权所有 www.hopenoah.com
京ICP备15061794号 京公网安备 11010502027115号